Cuando Boyle descubrió en 1661 su sencilla ley experimental sobre el comportamiento de los gases, trató de idear un modelo que interpretara coherentemente la naturaleza del gas. Ése fue el comienzo de la teoría cinética, desarrollada por Daniel Bernoulli, James Joule, Rudolph Clausius, Ludwig Boltzmann y Albert Einstein, entre otros científicos. Esta teoría se propone dar una explicación microscópica de las leyes macroscópicas experimentales.
Las hipótesis de las que parte son simples:
1) Un gas consiste en un conglomerado de partículas (átomos o moléculas) que responden a las leyes de la Mecánica newtoniana.
2) La enorme cantidad de partículas se mueven caóticamente y están tan separadas entre sí que su propio volumen es despreciable frente al que ocupa todo el gas.
3) No existen fuerzas apreciables sobre las partículas salvo las que operan durante los choques elásticos entre sí y contra las paredes.
La teoría cinética de los gases se enuncia en los siguientes postulados, teniendo en cuenta un gas ideal o perfecto:
1. Las sustancias están constituidas por moléculas pequeñísimas ubicadas a gran distancia entre sí; su volumen se considera despreciable en comparación con los espacios vacíos que hay entre ellas.
2. Las moléculas de un gas son totalmente independientes unas de otras, de modo que no existe atracción intermolecular alguna.
3. Las moléculas de un gas se encuentran en movimiento continuo, en forma desordenada; chocan entre sí y contra las paredes del recipiente, de modo que dan lugar a la presión del gas.
4. Los choques de las moléculas son elásticos, no hay pérdida ni ganancia de energía cinética, aunque puede existir transferencia de energía entre las moléculas que chocan.
5. La energía cinética media de las moléculas es directamente proporcional a la temperatura absoluta del gas; se considera nula en el cero absoluto.
Los gases reales existen, tienen volumen y fuerzas de atracción entre sus moléculas. Además, pueden tener comportamiento de gases ideales en determinadas condiciones: temperaturas altas y presiones muy bajas
Modelo corpuscular
Un modelo corpuscular para gases
De acuerdo con los postulados enunciados, podemos hacernos una imagen clara y concisa del modelo que represente el comportamiento de un gas.
Dicho modelo, debe ser el más elemental posible, debe explicar las propiedades observadas en los gases, debe contemplar la existencia de partículas muy pequeñas, de tamaño despreciable frente al volumen total, dotadas de grandes velocidades en constante movimiento caótico, chocando entre sí o con las paredes del recipiente. En cada choque se supone que no hay pérdida de energía y que no existe ningún tipo de unión entre las partículas que forman el gas.
Así, el concepto de presión, estará ligado al de los choques de las partículas sobre las paredes, debido al movimiento que llevan, presión que se ejerce sobre todas las direcciones, no existiendo direcciones privilegiadas. Así, cuantos más choques se produzcan, mayor es la presión del gas.
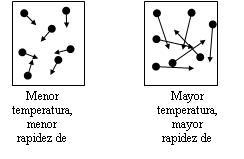
La temperatura, indicará la energía cinética media de las partículas: si la temperatura de un gas es superior a otro, sus partículas por término medio, poseen mayor velocidad.
Teoría cinética y temperatura.
La Temperatura es una propiedad de la materia que está relacionada con la distribución de la energía calorífica entre la materia de un cuerpo. Normalmente la temperatura mide la energía cinética media de las partículas:
A mayor energía cinética media (mayor movimiento de las partículas) mayor choque entre ellas, mayor temperatura.
A menor energía cinética media (menor movimiento de las partículas) habrá menos choques entre ellas, menor temperatura.
Teoría cinética y presión.
La presión que ejerce un gas sobre las paredes del recipiente que lo contiene son debidas a los choques que tienen lugar entre las partículas del gas y dichas paredes. La variación de la presión de un gas encerrado en un recipiente puede tener lugar por alguna de estas razones:
Por una variación de la temperatura manteniendo constante el volumen del recipiente que contiene el gas.
Un aumento de la temperatura aumenta la energía cinética media de las partículas, lo que provoca una mayor velocidad de las mismas y una mayor intensidad en los choques contra las paredes: aumenta la presión del recipiente que contiene el gas.
Un enfriamiento disminuirá la energía cinética media y las partículas chocaran con menos intensidad contra las paredes: disminuye la presión del recipiente que contiene el gas.
Por una variación del volumen que contiene el gas manteniendo constante la temperatura:
Si disminuye el volumen, las partículas se concentran y chocan con más frecuencia contra las paredes del recipiente que las contiene: aumenta la presión sobre las paredes del recipiente.
Si aumenta el volumen, las partículas se separan, tienen más volumen donde moverse y habrá menos partículas que choquen con las paredes del recipiente que contiene el gas: disminuye la presión del recipiente.
Los estados de agregación y la teoría cinética.
El estado de agregación de la materia nos indica la relación existente entre las partículas que integran la sustancia. Es decir, si las partículas se van a encontrar más cerca o más lejos en determinadas condiciones de presión o temperatura.
Por lo general, un aumento de la temperatura provoca un aumento de la energía cinética media (energía debida al movimiento) de las partículas que constituyen la materia. Este aumento de la energía cinética media se manifiesta:
En los gases por un aumento de la velocidad media con que se mueven las partículas.
En los sólidos y líquidos por un aumento de las vibraciones respecto a las posiciones más o menos fijas que adoptan las partículas.
En el estado de agregación líquido el movimiento de las moléculas se halla restringido en comparación con el estado gaseoso.
En el estado de agregación sólido, las moléculas ocupan posiciones fijas y su movimiento se reduce a vibraciones.
Como se puede esperar un aumento de la energía cinética media por un aumento de la temperatura dificultará que las fuerzas de cohesión que existen entre las partículas puedan mantener la estructura que tenían.
Por el contrario una disminución de la temperatura disminuye la energía cinética media de las partículas que constituyen la materia, favoreciendo las fuerzas de cohesión y una mayor estructura.
La teoría cinética y los cambios de estado.
¿Cómo se produce un cambio de estado? Los cambios de estado se pueden producir de dos formas:
Cambiando la temperatura a la que se encuentra una sustancia:
Si calentamos damos energía y las partículas disminuyen sus fuerzas de cohesión, aumenta la energía de vibración y pierde fortaleza la estructura más o menos rígida que poseen. El conjunto de partículas que forman dicha sustancia se desordena: cambios de estado progresivos (fusión, vaporización, sublimación).
Cambiando la presión a la que se encuentra una sustancia:
Si disminuimos la presión el sistema tiende a desordenarse ya que no se favorece el acercamiento de las partículas, disminuyen las fuerzas de cohesión y se favorece un cambio de estado progresivo (fusión, vaporización, sublimación).
Si aumentamos la presión se favorece el acercamiento de las partículas lo que produce un aumento de las fuerzas de cohesión y una tendencia a los cambios de estado regresivos (condensación, solidificación, sublimación regresiva).
Bibliografía:








No hay comentarios:
Publicar un comentario