PROPIEDADES COLIGATIVAS
Muchas de las propiedades de las disoluciones verdaderas se deducen del pequeño tamaño de las partículas dispersas. En general, forman disoluciones verdaderas las sustancias con un peso molecular inferior a 104 dalton. Algunas de estas propiedades son función de la naturaleza del soluto (color, sabor, densidad, viscosidad, conductividad eléctrica, etc.). Otras propiedades dependen del disolvente, aunque pueden ser modificadas por el soluto (tensión superficial, índice de refracción, viscosidad, etc.). Sin embargo, hay otras propiedades más universales que sólo dependen de la concentración del soluto y no de la naturaleza de sus moléculas. Estas son las llamadas propiedades coligativas.
Las propiedades coligativas no guardan ninguna relación con el tamaño ni con cualquier otra propiedad de los solutos.
Son función sólo del número de partículas y son resultado del mismo fenómeno: el efecto de las partículas de soluto sobre la presión de vapor del disolvente.
Las cuatro propiedades coligativas son:
- la presión de vapor del disolvente
- elevación ebulloscópica
- descenso crioscópico
- presión osmótica
La presión de vapor:
Esta propiedad esta reflejada en la Ley de Raoult, un científico francés, Francois Raoult quien enunció el siguiente principio: “La disminución de la presión del disolvente es proporcional a la fracción molar de soluto disuelto”.
Este principio ha sido demostrado mediante experimentos en los que se observa que las soluciones que contienen líquidos no volátiles o solutos sólidos, siempre tienen presiones más bajas que los solventes puros.
Las soluciones que obedecen a esta relación exacta se conocen como soluciones ideales. Las presiones de vapor de muchas soluciones no se comportan idealmente.
La presión de vapor de un disolvente desciende cuando se le añade un soluto no volátil. Este efecto es el resultado de dos factores:
- la disminución del número de moléculas del disolvente en la superficie libre
- la aparición de fuerzas atractivas entre las moléculas del soluto y las moléculas del disolvente, dificultando su paso a vapor
Pasos para calcular la presión de vapor de una solución:
El planteamiento del problema puede ser el siguiente: Calcule la presión de vapor de una solución a 26°C que contiene 10 gr. de Urea disuelta en 200 gr. de agua. Masa molecular de la urea: 60 g/mol. Masa molecular del agua: 18 g/mol
ELEVACIÓN EBULLOSCÓPICA
La temperatura de ebullición de un líquido es aquélla a la cual su presión de vapor iguala a la atmosférica.
Cualquier disminución en la presión de vapor (como al añadir un soluto no volátil) producirá un aumento en la temperatura de ebullición. La elevación de la temperatura de ebullición es proporcional a la fracción molar del soluto. Este aumento en la temperatura de ebullición (DTe) es proporcional a la concentración molal del soluto:
DTe = Ke m
La constante ebulloscópica (Ke) es característica de cada disolvente (no depende de la naturaleza del soluto) y para el agua su valor es 0,52 ºC/mol/Kg. Esto significa que una disolución molal de cualquier soluto no volátil en agua manifiesta una elevación ebulloscópica de 0,52 º C.
DESCENSO CRIOSCÓPICO
La temperatura de congelación de las disoluciones es más baja que la temperatura de congelación del disolvente puro. La congelación se produce cuando la presión de vapor del líquido iguala a la presión de vapor del sólido. Llamando Tc al descenso crioscópico y m a la concentración molal del soluto, se cumple que:
DTc = Kc m
siendo Kc la constante crioscópica del disolvente. Para el agua, este valor es 1,86 ºC/mol/Kg. Esto significa que las disoluciones molales (m=1) de cualquier soluto en agua congelan a -1,86 º C.
Presión osmótica
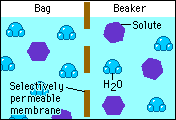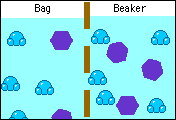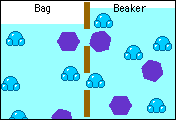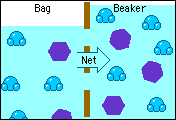
Esta propiedad se basa en el fenómeno de la ósmosis en el cual se selecciona el paso de sustancias a través de una membrana semipermeable que tiene poros muy pequeños que sólo permiten el paso de las moléculas del disolvente pero no del soluto.
Esto permite que dos soluciones de diferentes concentraciones separadas mediante una membrana semipermeable igualen sus concentraciones, debido al paso de las moléculas de solvente de la solución más diluida a la solución más concentrada, hasta alcanzar ambas la misma concentración.
El paso del disolvente desde la solución diluida hacia la solución concentrada provoca un aumento de la presión de la solución. Este incremento de la presión que se suma a la presión de vapor de la solución, se conoce como presión osmótica y se representa con la letra pi.
Las membranas se clasifican en cuatro grupos:
- · impermeables: no son atravesadas ni por solutos ni por el disolvente
- · semipermeables: no permiten el paso de solutos verdaderos, pero sí del agua
- · dialíticas: son permeables al agua y solutos verdaderos, pero no a los solutos coloidales
- · permeables: permiten el paso del disolvente y de solutos coloidales y verdaderos; sólo son impermeables a las dispersiones groseras
Se define la presión osmótica como la tendencia a diluirse de una disolución separada del disolvente puro por una membrana semipermeable.
Un soluto ejerce presión osmótica al enfrentarse con el disolvente sólo cuando no es capaz de atravesar la membrana que los separa. La presión osmótica de una disolución equivale a la presión mecánica necesaria para evitar la entrada de agua cuando está separada del disolvente por una membrana semipermeable.
Para medir la presión osmótica se utiliza el osmómetro, que consiste en un recipiente cerrado en su parte inferior por una membrana semipermeable y con un émbolo en la parte superior.
Si introducimos una disolución en el recipiente y lo sumergimos en agua destilada, el agua atraviesa la membrana semipermeable y ejerce una presión capaz de elevar el émbolo hasta una altura determinada. Sometiendo el émbolo a una presión mecánica adecuada se puede impedir que pase el agua hacia la disolución, y el valor de esta presión mecánica mide la presión osmótica.
Se definen tres tipos de disoluciones:
- · disoluciones isotónicas. son aquéllas que manifiestan la misma presión osmótica que la disolución de referencia
- · disoluciones hipotónicas. son aquéllas que manifiestan menor presión osmótica que la disolución de referencia
- · disoluciones hipertónicas. son aquéllas que manifiestan mayor presión osmótica que la disolución de referencia
La membrana del eritrocito puede considerarse como una membrana semipermeable, que permite el paso del agua, pero no de las sales. En un medio isotónico (de igual presión osmótica), el eritrocito permanece inalterable.
Si el eritrocito se introduce en agua destilada o en un medio hipotónico el agua atravesará la membrana hacia el citoplasma, con lo que aumenta el volumen celular, distendiendo la membrana hasta que llega un punto en que ésta se rompe. Este fenómeno se conoce con el nombre de hemolisis.
Si el eritrocito se pone en un medio hipertónico (de mayor presión osmótica), el agua sale del eritrocito hacia el exterior, con lo cual su volumen disminuye, y la membrana se retrae, de forma que ofrece al microscopio un aspecto estrellado.
Resulta, por tanto, vital para la célula mantener constante la presión osmótica del medio intersticial. Cuando la célula se encuentra en un medio donde la osmolaridad es distinta a la de su medio interno, tanto su funcionamiento como su propia integridad se encontrarán amenazados.
Bibliografía






















No hay comentarios:
Publicar un comentario