Se define la presión osmótica como la tendencia a diluirse de una disolución separada del disolvente puro por una membrana semipermeable. Un soluto ejerce presión osmótica al enfrentarse con el disolvente sólo cuando no es capaz de atravesar la membrana que los separa. La presión osmótica de una disolución equivale a la presión mecánica necesaria para evitar la entrada de agua cuando está separada del disolvente por una membrana semipermeable.
Esto permite que dos soluciones de diferentes concentraciones separadas mediante una membrana semipermeable igualen sus concentraciones, debido al paso de las moléculas de solvente de la solución más diluida a la solución más concentrada, hasta alcanzar ambas la misma concentración.
El paso del disolvente desde la solución diluida hacia la solución concentrada provoca un aumento de la presión de la solución. Este incremento de la presión que se suma a la presión de vapor de la solución, se conoce como presión osmótica y se representa con la letra 

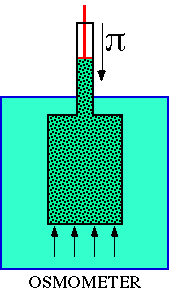
Para medir la presión osmótica se utiliza el osmómetro, que consiste en un recipiente cerrado en su parte inferior por una membrana semipermeable y con un émbolo en la parte superior. Si introducimos una disolución en el recipiente y lo sumergimos en agua destilada, el agua atraviesa la membrana semipermeable y ejerce una presión capaz de elevar el émbolo hasta una altura determinada. Sometiendo el émbolo a una presión mecánica adecuada se puede impedir que pase el agua hacia la disolución, y el valor de esta presión mecánica mide la presión osmótica.
Si comparamos la presión osmótica de dos disoluciones podemos definir tres tipos de disoluciones:
Disoluciones isotónicas son aquéllas que manifiestan la misma presión osmótica que la disolución de referencia
Disoluciones hipotónicas son aquéllas que manifiestan menor presión osmótica que la disolución de referencia
Disoluciones hipertónicas son aquéllas que manifiestan mayor presión osmótica que la disolución de referencia
La membrana del eritrocito puede considerarse como una membrana semipermeable, que permite el paso del agua, pero no de las sales. En un medio isotónico (de igual presión osmótica), el eritrocito permanece. Si el eritrocito se introduce en agua destilada o en un medio hipotónico el agua atravesará la membrana hacia el citoplasma, con lo que aumenta el volumen celular, distendiendo la membrana hasta que llega un punto en que ésta se rompe. Este fenómeno se conoce con el nombre de hemolisis. Si el eritrocito se pone en un medio hipertónico (de mayor presión osmótica), el agua sale del eritrocito hacia el exterior, con lo cual su volumen disminuye, y la membrana se retrae, de forma que ofrece al microscopio un aspecto estrellado.
Cálculo de la presión osmótica
C: molaridad o molalidad
R: valor constante 0,082 L atm/°K x mol
T: temperatura expresada en °K. Si el valor de la temperatura está expresado en ºC, se suma a este valor 273. Ejemplo: Temperatura: 20 ºC, 20ºC + 273 = 293ºK
A continuación se presenta un problema tipo de presión osmótica:
Halle la presión osmótica de una solución de glucosa que contiene 12 gr. de la sustancia en 500 ml de solución a una temperatura de 298ºK. Masa molecular de la glucosa = (MM): 180 g/mol
Paso 1: Cálculo de la molalidad o molaridad:
Paso 2: Cálculo de la presión osmótica
= 0,13 g/mol x 0,082 x 298°K
= 3,176 atm
Bibliografía:





No hay comentarios:
Publicar un comentario